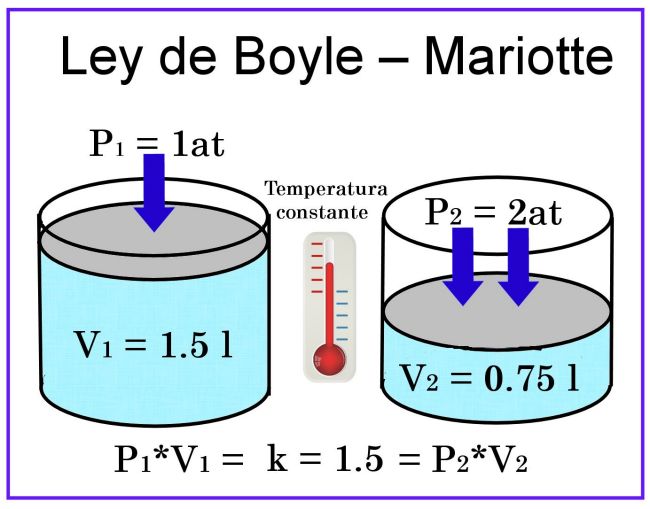
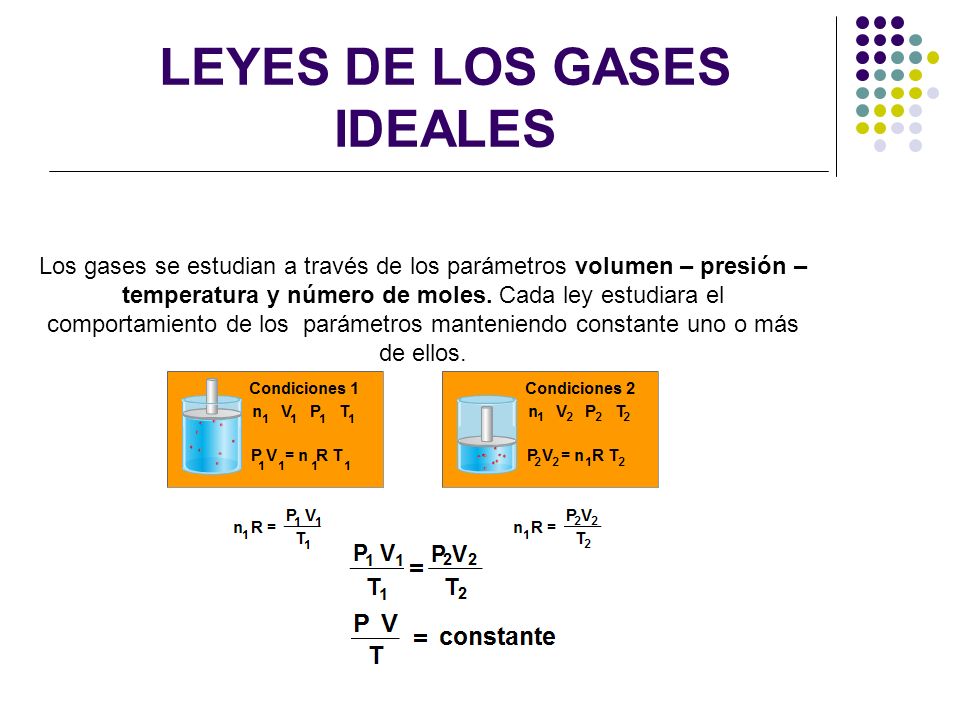
Aplicaciones
Presión atmosférica, práctica
deportiva, efecto invernadero e inversión térmica
La Presión atmosférica se refiere a un diferencial,
una columna imaginaria de aire a la que se le mide su peso en un punto determinado en la superficie terrestre. Esta
columna, ejerce presión sobre el punto arrojando un valor. Esto es presión
atmosférica básicamente. El cálculo se ejecuta de la siguiente manera: A menor
peso de la columna, menor será la presión ejercida y viceversa. Todo dependerá
de la cantidad y lo concentrado de las moléculas.
Cuando el aire se encuentra
muy frío, la atmósfera es estable, presentando niveles de presión atmosférica
estables, pero cuando el aire cambia drásticamente su temperatura se pueden
producir cambios bruscos de presión lo que conduce a ciclones y huracanes que
perturban a la atmósfera. Por ejemplo, existen corrientes de aire caliente que
llegan a una atmósfera estable provocando una mezcla de temperatura, estas
hacen que la presión disminuya creando inestabilidad, si esto sucede a baja
altura, por el contrario, al suceder en una altura más elevada, la
inestabilidad de la atmósfera se verá regulada por los procesos.La presión
atmosférica se mide por medio de instrumento de medición llamado barómetro, El
valor medio de la presión de la atmósfera terrestre es de 1013.25 hectopascales
o milibares a nivel del mar, la cual está medida a una latitud de 45°.
La creación del Barómetro se
debe a los estudios de Evangelista Torricelli, El enunciado de Torricelli dice
textualmente: “Si sucede que la altura de la plata viva es menor en lo alto de
la montaña, que abajo, se deducirá necesariamente que la gravedad y presión del
aire son la única causa de esta suspensión de la plata viva, y no el horror al
vacío, porque es verdad que hay mucho más aire que pese al pie de la montaña
que en su vértice”. (Conceptodefinicion.de, 2014)
Cuando
practicamos deporte no solamente incidimos sobre nuestros músculos, es mucho
más lo que sucede en nuestro organismo. Muchas veces hemos comentado la unión
que hay entre el cuerpo y la mente, y en el terreno deportivo no iba a ser
menos, ya que cuando practicamos deporte se desencadena todo un proceso
químico en
nuestro cuerpo que interfiere directamente en nuestra psicología. Al terminar
de realizar cualquier actividad deportiva solemos sentirnos satisfechos y
experimentamos una sensación de tranquilidad y alegría. Esta sensación no es
algo que se produce por azar, sino que tiene una explicación, ya que cuando
sometemos a nuestros músculos a un esfuerzo determinado, nuestro organismo
libera una serie de sustancias químicas, se trata de las conocidas como endorfinas. (Viotonica,
2009)
El
efecto invernadero es un fenómeno
por el cual ciertos gases retienen parte de la energía emitida por el suelo
tras haber sido calentado por la radiación solar. Se produce, por lo tanto, un
efecto de calentamiento similar al que ocurre en un invernadero, con una
elevación de la temperatura.
Aunque
el efecto invernadero se produce por la acción de varios componentes de la
atmósfera planetaria, el proceso de calentamiento ha sido acentuado en las
últimas décadas por la acción del hombre, con la emisión de dióxido de carbono,
metano y otros gases.
Así,
además de esos dos citados gases también se encuentran el vapor de agua, el
óxido de nitrógeno, el cloro fluoro carbono y el ozono. Elementos todos ellos
que son naturales pero que, a raíz de la conocida Revolución Industrial en la
que comenzó una intensa actividad en materia del uso de lo que son combustibles
fósiles, han visto incrementar su presencia en la atmósfera y eso origina la
situación de efecto invernadero que ahora nos ocupa. (Definicion.de, S.F)
¿Qué
es una inversión térmica?
Es
un fenómeno que se presenta cuando en las noches despejadas el suelo ha perdido
calor por radiación, las capas de aire cercanas a él se enfrían más rápido que
las capas superiores de aire lo cual provoca que se genere un gradiente
positivo de temperatura con la altitud (lo que es un fenómeno contrario al que
se presenta normalmente, la temperatura de la troposfera disminuye con la
altitud).
Esto
provoca que la capa de aire caliente quede atrapada entre las 2 capas de aire
frío sin poder circular, ya que la presencia de la capa de aire frío cerca del
suelo le da gran estabilidad a la atmósfera porque prácticamente no hay
convección térmica, ni fenómenos de transporte y difusión de gases y esto hace
que disminuya la velocidad de mezclado vertical entre la región que hay entre
las 2 capas frías de aire.
¿Cuánto
se presenta?
Este
fenómeno climatológico se presenta normalmente en las mañanas frías sobre los
valles de escasa circulación de aire en todos los ecosistemas terrestres.
También se presenta este fenómeno en las cuencas cercanas a las laderas de las
montañas en noches frías debido a que el aire frío de las laderas desplaza al
aire caliente de la cuenca provocando el gradiente positivo de temperatura.
¿Por
qué ocurre?
Cuando
se emiten contaminantes al aire en condiciones de inversión térmica, se
acumulan (aumenta su concentración) debido a que los fenómenos de transporte y
difusión de los contaminantes ocurren demasiado lentos, provocando graves
episodios de contaminación atmosférica de consecuencias graves para la salud de
los seres vivos. (durango, 2003)
BIBLIOGRAFIAS:
Conceptodefinicion.de.
(18 de Octubre de 2014). Conceptodefinicion.de. Recuperado el 2 de
noviembre de 2016, de Conceptodefinicion.de :
http://conceptodefinicion.de/presion-atmosferica/
Definicion.de. (S.F). Definicion.de. Recuperado el 2
de noviembre de 2016, de Definicion.de:
http://definicion.de/efecto-invernadero/
durango, E. s. (7 de diciembre de 2003). Inversión térmica
. Recuperado el 2 de noviembre de 2016, de Inversión térmica:
http://www.elsiglodedurango.com.mx/noticia/19396.que-es-una-in
Viotonica. (3 de mayo de 2009). Viotonica . Recuperado
el 2 de noviembre de 2016, de Viotonica :
http://www.vitonica.com/wellness/la-practica-deportiva-un-aliado-de-la-felicidad